Iliakale Seitarmprothesen zur Behandlung von Typ-Ib-Endoleaks nach EVAR
Einleitung
Das infrarenale Bauchaortenaneurysma (BAA) wird bei geeigneter Anatomie seit ca. 10 Jahren häufiger endovaskulär (EVAR, endovascular aortic repair) als offen chirurgisch versorgt: Heute werden in der westlichen Welt ca. 80 % der BAAs endovaskulär behandelt [1]. Im Langzeitverlauf wurden im Vergleich mit der offenen Versorgung höhere Reinterventionsraten nach EVAR berichtet [2]. Die häufigsten Revisionseingriffe werden wegen Endoleaks (EL) indiziert und überwiegend endovaskulär durchgeführt [3]. Eine dominante Rolle spielen in diesem Zusammenhang Typ-I- und -II-EL, wobei erstere immer und letztere meist nur bei relevanter Expansion des Aneurysmasackes behandelt werden. Die Mehrzahl der Publikationen zum Themenkomplex der Typ-I-EL widmet sich thematisch dem proximalen, also Typ-Ia-EL. In der Literatur unterrepräsentiert sind Behandlungsdaten zum distalen Typ-Ib-EL, welches jedoch genauso relevant erscheint, da es zur kontinuierlichen Druckerhöhung im Aneurysmasack beiträgt und somit zur Ruptur führen kann [2, 4]. Die Undichte in der distalen Landezone kann im frühen post-interventionellen Verlauf nach EVAR auftreten und ist dann meist die Folge einer falschen (unterdimensionierten) Größenwahl des Prothesenschenkels. Im mittel- bis langfristigen Verlauf kann es aber auch bei initial korrekt gewählter Prothese zum Typ-Ib-EL kommen, wenn die ehemals geeignete distale Landezone aneurysmatisch degeneriert [4]. Die endovaskulären Behandlungsoptionen sind in beiden Fällen identisch. Sowohl die überlappende Verlängerung der Prothese in die nicht-aneurysmatische A. iliaca externa (mit und ohne Embolisation der ipsilateralen A. iliaca interna) [5], die Implantation von parallelen Stentgrafts [6], als auch die überlappende Implantation einer iliakalen Seitarmprothese [4] wurden in einem solchen Szenario erfolgreich durchgeführt.
Fallbericht
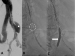
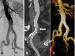
Ein 71-jähriger Patient stellte sich mit einer CTA-Kontrolle nach EVAR in unserem Krankenhaus vor. Vier Jahre zuvor war ein infrarenales BAA durch Stentgraft-Implantation ausgeschaltet worden. Zwischen der letzten und aktuellen CT-angiographischen Nachkontrolle lagen 38 Monate, in denen der Aneurysmasack um 10 mm gewachsen war. Neu beschrieben war nun ein Typ-Ib-EL am linken Prothesenschenkel (Abb. 1a–c, weißer Pfeil). Angiographisch bestätigte sich das EL (Abb. 2a, Sternchen). Um die ipsilaterale A. iliaca interna (AII) zu erhalten, wurde die Implantation einer iliakalen Seitarmprothese geplant. Über einen perkutanen, transbrachialen Zugang (8F) wurde ein 0,035“-Draht mit einer Schlinge gefasst und links femoral ausgeleitet, parallel ein steifer Führungsdraht in der Aorta platziert. Nach einer Planungsangiographie (Abb. 2a) zur Lokalisation des Ostiums der AII wurde die femorale Schleuse entfernt und über beide Drähte ein E-liac® Stentgraft (JOTEC GmbH, Hechingen, Germany) perkutan eingebracht. Die Prothese wurde folgend so ausgerichtet, dass der den Seitarm anzeigende „E“-Marker der Prothese (Abb. 2b, Kreis) in Richtung des Ostiums der AII orientiert war. Anschließend wurde eine Angiographie des Internastromgebietes durchgeführt, um die Landezone zu lokalisieren. Die AII wurde von transbrachial durch den Seitarm sondiert. Abschließend erfolgte die Implantation eines ballon-expandierbaren Stentgrafts in die AII (Abb. 2c), bevor ein Bridging-Stentgraft zwischen iliakaler Seitarmprothese und zuvor implantierter infrarenaler Bifurkationsprothese den Eingriff vervollständigte. In der Abschlussangiographie sowie der post-interventionellen CTA war das EL nicht mehr nachweisbar (Pfeil), die Perfusion der AII weiterhin erhalten (Abb. 3).
Diskussion
Die meisten infrarenalen BAAs werden heute endovaskulär versorgt [1]. Kontinuierliche bildgebende Verlaufskontrollen sind nach EVAR unverzichtbar. In Bezug auf die distale Landezone in der A. iliaca communis (AIC) weisen Studien darauf hin, dass in einem Viertel der Patienten mit einem BAA auch die AIC von der Erkrankung mitbetroffen ist [7]. Korrelierend hierzu konnte eine relevante Expansion der AIC bei einem Viertel von EVAR-Patienten festgestellt werden, die bildgebend nachuntersucht worden waren [8]. Wie auch im oben vorgestellten Fall liegt die Dauer zwischen EVAR und Diagnose eines Typ-Ib-Endoleaks (EL) bei von einer aneurysmatischen Expansion betroffenen Patienten zwischen 30 und 55 Monaten [4, 8, 9]. Dies unterstreicht die Notwendigkeit der Nachkontrollen auch mehrere Jahre nach dem Eingriff. Darüber hinaus scheint das Risiko, ein Typ-Ib-EL zu entwickeln, maßgeblich vom Diameter der Landezone zum Zeitpunkt der EVAR abzuhängen. Prädisponierend für ein solches EL erscheinen Gefäßdurchmesser > 16 mm bzw. Prothesendurchmesser oberhalb 20 mm zu sein [8–11]. So ist das Risiko für die Entwicklung eines Typ-Ib-EL nach Implantation von Prothesenschenkeln > 20 mm 5x höher als für kleinere Durchmesser [10]. Tritt ein solches EL auf, bestehen mehrere endovaskuläre Behandlungsoptionen. Zum einen kann der nicht mehr dichtende Prothesenschenkel überlappend in die gesunde A. iliaca externa verlängert werden, und zwar mit oder ohne Embolisation der AII. Dies ist der am häufigsten verwendete Therapieansatz in der publizierten Literatur [12]. Ein Viertel der so behandelten Patienten leidet akut oder chronisch an einer Minderdurchblutung der Beckeneingeweide, wobei die Gesäßclaudicatio die häufigste Komplikation darstellt [13]. Hieraus kann man folgern, dass die pelvine Durchblutung zu erhalten ist, wann immer dies möglich erscheint. Hierfür können u. a. die Chimney- [6] oder Sandwich-Technik [14] angewendet werden. Eine andere Option besteht in der überlappenden Implantation einer iliakalen Seitarmprothese. Diese sind „off-the-shelf“ in unterschiedlichen Konfigurationen von aktuell drei Herstellern mit CE-Kennzeichnung verfügbar. Für die Behandlung nativer aorto-iliakaler Aneurysmen wurden hinsichtlich des implantierten E-liac® Stentgrafts (JOTEC GmbH, Hechingen) vielversprechende Ergebnisse mit hohem technischen Erfolg, niedrigen Komplikations- und hohen Offenheitsraten für den Seitarm publiziert [15, 16]. Diese Ergebnisse sollten auch auf den Revisionseingriff für ein Typ-Ib-EL nach EVAR übertragbar sein. Bisdas et al. publizierten in diesem Zusammenhang eine kleine Serie zur Behandlung von Typ-Ib-EL durch Implantation einer anderen iliakalen Seitarmprothese und berichteten über hohe technische Erfolgs- und Offenheitsraten [4].
Zusammenfassend stellt das Typ-Ib-Endoleak eine wichtige Komplikation nach EVAR dar. Die überlappende Implantation einer iliakalen Seitarmprothese erscheint bei geeigneter Anatomie die ideale endovaskuläre Lösung, um gleichzeitig die Beckendurchblutung zu erhalten und die Landezone in die nicht erkrankte A. iliaca externa zu transpositionieren.
Literatur:
1. Ullery BW, Hallett RL, Fleischmann D. Epidemiology and contemporary management of abdominal aortic aneurysms. Abdom Radiol 2018; 43: 1032–43.
2. Powell JT, Sweeting MJ, Ulug P, et al. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg 2017; 104: 166–78.
3. de la Motte L, Falkenberg M, Koelemay MJ, et al. Is EVAR a durable solution? Indications for reinterventions. J Cardiovasc Surg 2018; 59: 201–12.
4. Bisdas T, Weiss K, Donas KP, et al. Use of iliac branch devices for endovascular repair of aneurysmal distal seal zones after EVAR. J Endovasc Ther 2014; 21: 579–86.
5. Papazoglou KO, Sfyroeras GS, Zambas N, et al. Outcomes of endovascular aneurysm repair with selective internal iliac artery coverage without coil embolization. J Vasc Surg 2012; 56: 298–303.
6. Heckenkamp J, Brunkwall J, Luebke T, et al. Novel chimney-graft technique for preserving hypogastric flow in complex aortoiliac aneurysms. J Cardiovasc Surg 2012; 53: 773–6.>/p>
7. Norman PE, Powell JT. Site specificity of aneurysmal disease. Circulation 2010; 121: 560–8
8. Falkensammer J, Hakaim AG, Andrew Oldenburg W, et al. Natural history of the iliac arteries after endovascular abdominal aortic aneurysm repair and suitability of ectatic iliac arteries as a distal sealing zone. J Endovasc Ther 2007; 14: 619–24.
9. McDonnell CO, Semmens JB, Allen YB, et al. Large iliac arteries: a high-risk group for endovascular aortic aneurysm repair. J Endovasc Ther 2007; 14: 625–9.
10. Gray D, Shahverdyan R, Reifferscheid V, et al. EVAR with Flared Iliac Limbs has a High Risk of Late Type 1b Endoleak. Eur J Vasc Endovasc Surg 2017; 54: 170–6.
11. Richards T, Dharmadasa A, Davies R, et al. Natural history of the common iliac artery in the presence of an abdominal aortic aneurysm. J Vasc Surg 2009; 49: 881–5.
12. Bianchini Massoni C, Perini P, Tecchio T, et al. A systematic review of treatment modalities and outcomes of type Ib endoleak after endovascular abdominal aneurysm repair. Vascular 2018; 26: 90–8.
13. Kouvelos GN, Katsargyris A, Antoniou GA, et al. Outcome after Interruption or Preservation of Internal Iliac Artery Flow During Endovascular Repair of Abdominal Aorto-iliac Aneurysms. Eur J Vasc Endovasc Surg 2016; 52: 621–34.
14. Lobato AC, Camacho-Lobato L. Endovascular treatment of complex aortic aneurysms using the sandwich technique. J Endovasc Ther 2012; 19: 691–706.
15. Mylonas SN, Rumenapf G, Schelzig H, et al. A multicenter 12-month experience with a new iliac side-branched device for revascularization of hypogastric arteries. J Vasc Surg 2016; 64: 1652–9.
16. Anton S, Wiedner M, Stahlberg E, et al. Initial Experience with the E-liac((R)) Iliac Branch Device for the Endovascular Aortic Repair of Aorto-iliac Aneurysm. Cardiovasc Intervent Radiol 2018; 41: 683–91.
Autor:
PD Dr. med. Jan Peter Goltz, EBIR
Klinik für Radiologie und Nuklearmedizin, Sektion Interventionelle Radiologie
Universitätsklinikum Schleswig-Holstein, Campus Lübeck, Deutschland
JOTEC GmbH, a fully owned subsidiary of CryoLife, Inc.
Lotzenäcker 23, D-72379 Hechingen
www.jotec.com