Juch H, Dohr G Zur funktionellen Bedeutung des löslichen Oberflächen-Antigens HLA-G in der Blastozysenkultur der Assistierten Reproduktion Journal für Reproduktionsmedizin und Endokrinologie - Journal of Reproductive Medicine and Endocrinology 2004; 1 (3): 165-170 Volltext (PDF) Summary Übersicht
| ||||||
Abbildung 3: sHLG-G-Fangantikörper-ELISA-Aufbau sHLA-G-Fangantikörper-ELISA-Aufbau. Die drei möglichen Fangantikörper-ELISA-Systeme zur Detektion von HLA-G schematisch: Während im Ansatz A alle HLA-Klasse-1-Moleküle inklusive HLA-G detektierbar sind, man also nicht von einer HLA-G-Spezifität sprechen kann, ist Ansatz B spezifisch, da zumindest ein HLA-G-spezifischer Fangantikörper verwendet wird. Das spezifischste System (C) verwendet zwei HLA-G-spezifische Antikörper und bringt daher die zuverlässigsten Positivsignale. Die beiden in einem solchen "Sandwich"-ELISA verwendeten Antikörper müssen grundsätzlich an unterschiedlichen Stellen am HLA-G-Molekül binden. Diese Bindungsstellen müssen auch räumlich weit genug voneinander entfernt sein, damit sich die Antikörper nicht gegenseitig behindern. |
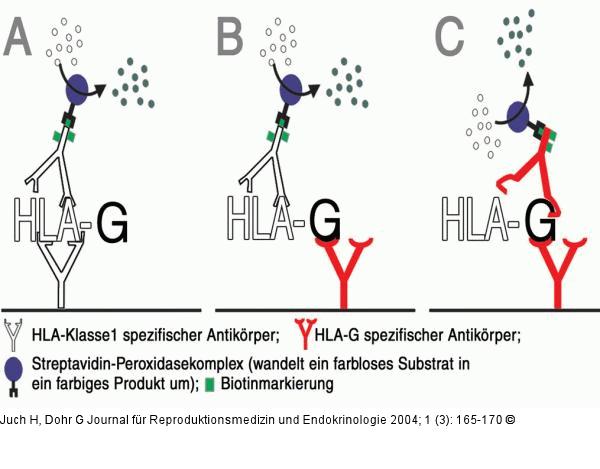
Abbildung 3: sHLG-G-Fangantikörper-ELISA-Aufbau
sHLA-G-Fangantikörper-ELISA-Aufbau. Die drei möglichen Fangantikörper-ELISA-Systeme zur Detektion von HLA-G schematisch: Während im Ansatz A alle HLA-Klasse-1-Moleküle inklusive HLA-G detektierbar sind, man also nicht von einer HLA-G-Spezifität sprechen kann, ist Ansatz B spezifisch, da zumindest ein HLA-G-spezifischer Fangantikörper verwendet wird. Das spezifischste System (C) verwendet zwei HLA-G-spezifische Antikörper und bringt daher die zuverlässigsten Positivsignale. Die beiden in einem solchen "Sandwich"-ELISA verwendeten Antikörper müssen grundsätzlich an unterschiedlichen Stellen am HLA-G-Molekül binden. Diese Bindungsstellen müssen auch räumlich weit genug voneinander entfernt sein, damit sich die Antikörper nicht gegenseitig behindern. |