Genetische Heterogenität der angeborenen Samenleiteraplasie
C. Kirchhoff
Eingegangen: 21. Februar 2018; akzeptiert nach Revision: 25. April 2018 (verantwortlicher Rubrik-Herausgeber: F. Tüttelmann, Münster)
Korrespondenzadresse: Prof. Dr. Christiane Kirchhoff, Caspar-von-Saldern-Weg 3, D-24582 Bordesholm, E-Mail: ckirchhoff51@gmail.com
Mutationen im CFTR-Gen waren lange Zeit die einzige bekannte genetische Ursache für obstruktive Azoospermie aufgrund einer angeborenen beidseitigen Samenleiteraplasie (CBAVD). Mithilfe von Methoden der Hochdurchsatzsequenzierung wurden jetzt Mutationen im ADGRG2-Gen, das einen G-Protein-gekoppelten Adhäsionsrezeptor kodiert, als weitere Ursache identifiziert. Der Phänotyp gleicht dem durch bestimmte CFTR-Mutationen hervorgerufenen Bild einer isoliert auftretenden, kongenitalen, bilateralen Aplasie der Samenleiter (CBAVD). Die gezielte Zerstörung von Adgrg2 im Tiermodell führte ebenfalls zu männlicher Infertilität durch Stase der Spermien in den Ductuli efferentes und Flüssigkeitsrückstau in das Rete testis.
Mutationen im ADGRG2-Gen als molekulare Ursache der CBAVD ohne Nierenfehlbildung sollten bei der humangenetischen Beratung von betroffenen Kinderwunschpaaren in Erwägung gezogen werden, zumal sich aus der Lokalisation des Gens auf dem X-Chromosom (CBAVDX, OMIM-Eintrag 300572) im Unterschied zum autosomal gelegenen CFTR abweichende Prognosen ergeben.
Tatsächlich kontrollieren zahlreiche Gene die Elektrolytbalance und Viskosität der luminalen Flüssigkeit und damit den Spermientransport in den ableitenden Samenwegen. Möglicherweise kommt es zu einer Interaktion zwischen ADGRG2-Rezeptor und CFTR sowie weiteren Ionenkanälen, eine mögliche Erklärung für die genetische Heterogenität.
Schlüsselwörter: Adhäsions-G-Protein gekoppelter Rezeptor ADGRG2, obstruktive Azoospermie, Ductuli efferentes, Störung der Elektrolytbalance
Genetic Heterogeneity of Congenital Vas Deferens Aplasia. For a long time, CFTR was the only known gene whose mutations lead to obstructive azoospermia because of aplasia of the vas deferens. Now deep sequencing methods identified an additional molecular cause of congenital bilateral vas deferens aplasia (CBAVD): patients presented with truncating mutations in ADGRG2, a large X chromosomal gene encoding a G-protein coupled adhesion receptor. The phenotype equals that of isolated CBAVD caused by CFTR mutations.
Targeted deletion („knockout“) of the Adgrg2 gene in mice likewise resulted in male infertility caused by obstructive azoospermia. The mutant male mice revealed dysregulation of fluid reabsorbtion and sperm transport, leading to sperm stasis within the efferent ducts and fluid back pressure into the rete testis. Thus, ADGRG2 mutations should be considered during diagnosis and genetic counselling of affected couples seeking infertility treatment by TESE/ISCI. X-chromosomal linkage of ADGRG2 (CBAVDX, OMIM entry 300572; different from the autosomal CFTR) will affect the prognosis.
Interactions between the ADGRG2 receptor and the CFTR and/or other ion channels involved in fluid reabsorption could explain the genetic heterogeneity of this phenotype. J Reproduktionsmed Endokrinol_Online 2018; 15 (3): 136–42.
Key words: Adhesion G-protein coupled receptor ADGRG2, obstructive azoospermia, efferent ducts, dysregulation of fluid reabsorption
Einleitung
Die Samenleiteraplasie ist eine angeborene Fehlbildung des männlichen Genitaltraktes, die zu obstruktiver Azoospermie führt, wenn sie beidseitig auftritt. Etwa 2 % der infertilen Männer sind davon betroffen. Ihnen fehlen die Derivate des Wolff’schen Gangs vollständig oder teilweise, vor allem Samenleiter und Samenblasen, oft aber auch Teile des Nebenhodens [1].
Einzig der Nebenhodenkopf, der beim Mann zum größten Teil aus den nicht vom Wolff’schen Gang abzuleitenden Ductuli efferentes besteht, ist stets vorhanden und vielfach deutlich aufgetrieben. Die betroffenen Männer haben ein signifikant verringertes Ejakulatvolumen sowie einen erniedrigten pH-Wert und eine erniedrigte Fruktosekonzentration im Ejakulat. Hormonproduktion und Spermatogenese sind dagegen in der Regel nicht beeinträchtigt. Deshalb ist die testikuläre Spermienextraktion (TESE) mit anschließender intrazytoplasmatischer Spermieninjektion (ICSI) die übliche Therapieform bei Kinderwunsch; eine operative Rekonstruktion des Genitaltrakts ist nicht möglich [1].
Die Pathogenese der angeborenen Samenleiteraplasie ist bis heute nur unvollständig verstanden, unter anderem, weil es kaum geeignete Tiermodelle gibt. Es wird vermutet, dass die Ursache in einer Störung der Elektrolytbalance im Genitaltrakt liegt. Diese Hypothese wird durch den Befund gestützt, dass in vielen Fällen Mutationen im CFTR- (Cystic fibrosis transmembrane conductance regulator-) Gen ursächlich für die Samenleiteraplasie sind [2–4]. Das autosomale CFTR-Gen (lokalisiert auf Chromosom 7q31.2) kodiert einen Signal-gesteuerten Bicarbonat- und Chlorid-Ionenkanal, der apikal im Epithel „tubulär“ aufgebauter Organe exprimiert wird, darunter der männliche Genitaltrakt. CFTR-Mutationen sind als molekulare Ursache des Krankheitsbildes der zystischen Fibrose (CF) gut belegt; sie führen zu einer gestörten Elektrolytbalance in den betroffenen Organen, bedingt durch das Fehlen oder eine stark eingeschränkte Funktion des CFTR-Ionenkanals.
Auch die Samenleiteraplasie wird auf den Verlust der CFTR-Funktion zurückgeführt, indem der zunehmend zähflüssige Inhalt des Genitaltrakts zur Obstruktion und schließlich zur Degeneration der ableitenden Samenwege führen soll. Tatsächlich zeigen Männer mit manifester CF fast immer auch ein angeborenes Fehlen der Derivate des Wolff’schen Gangs [1].
Daneben kann eine beidseitige Samenleiteraplasie auch isoliert, d. h. ohne CF-Symptome, auftreten; als Bezeichnung für diese Störung ist das Akronym CBAVD („congenital bilateral absence of Vas deferens“) gebräuchlich [1]. Bei Einsatz einer umfassenden molekularen Analysestrategie wird bei etwa 80 % der Patienten mindestens eine Mutation im CFTR-Gen gefunden; das Spektrum der beteiligten Mutationen ist jedoch ein anderes als bei manifester CF [5, 6]. Auch bei kongenitaler unilateraler Aplasie des Vas deferens (CUAVD) sind CFTR-Mutationen beschrieben worden [7]. Bei einigen dieser Patienten besteht eine ausgeprägte Oligozoospermie. Bei Verdacht auf das Vorliegen einer Samenleiteraplasie wird betroffenen Männern vor einer Kinderwunschbehandlung heute eine molekulargenetische Untersuchung auf das Vorliegen einer der populationsspezifisch häufigsten CFTR-Mutationen angeboten. Bei Nachweis einer solchen Mutation wird die humangenetische Beratung auf die Partnerin ausgedehnt, um das Erkrankungsrisiko für eventuelle gemeinsame Nachkommen abzuschätzen [1].
Mutationen im CFTR-Gen waren lange Zeit die einzige bekannte genetische Ursache für obstruktive Azoospermie [1, 8]. Die isoliert auftretende CBAVD wird deshalb oft als Minimalmanifestation oder Abortivform der CF gewertet. Detaillierte klinische Untersuchungen und genetische Familienstudien zeigten jedoch bereits in der Vergangenheit, dass die Beziehung zwischen CF und CBAVD komplex ist [9]. Etwa 10–20 % der Fälle in der kaukasischen Bevölkerung werden offenbar nicht durch CFTR-Mutationen verursacht [10]. So sind bei Patienten mit begleitenden Nierenanomalien (unilaterale Aplasie, Fehlbildungen oder Dystopie) fast nie CFTR-Mutationen nachweisbar [11]. Das gleiche gilt anscheinend für Patienten, bei denen abweichend vom üblichen Krankheitsbild die Samenblasen und der distale ampulläre Teil der Samenleiter ausgebildet sind. Diese Formen der CBAVD wurden deshalb schon früh als eigenständige Erkrankungen angesehen, die andere genetische Ursachen haben. Die nachweislich durch CFTR-Mutationen verursachte Samenleiteraplasie wird demgegenüber auch als CF-CBAVD bezeichnet [4].
Genom-Sequenzierung zum Aufspüren neuer Mutationen bei isolierter CBAVD
Jetzt bestätigt sich, dass eine solche Abgrenzung anscheinend nicht nur unter klinischen Gesichtspunkten ihre Berechtigung hat, sondern dass die CBAVD tatsächlich eine genetisch heterogene Störung darstellt. Humangenetiker der Universitätskliniken Toulouse und Lille entdeckten mithilfe einer „Whole exome sequencing-“ (WES-) Strategie „trunkierende“ (= Protein-verkürzende) Mutationen im ADGRG2-Gen als weitere molekulare Ursache der CBAVD [12]. Die Grundlage ihrer retrospektiven Untersuchung bildete eine große Kohorte aus 379 azoospermen Patienten mit klinisch gesicherter, isoliert auftretender CBAVD, die in den letzten 10 Jahren in Toulouse und Lille in andrologischer Behandlung waren. Bei 81 von ihnen (21 %) hatte die vollständige Sequenzanalyse aller 27 Exons keine Hinweise auf Mutationen im CFTR-Gen ergeben; aus dieser Gruppe wurden schließlich 54 Patienten für die Exom-Sequenzierung ausgewählt [12]. Davon zeigten 28 Männer zusätzlich eine Nierenfehlbildung, 26 waren ohne begleitende Nierenanomalien. Bei letzteren bestand kein phänotypischer Unterschied zu Männern, deren Samenleiteraplasie gesichert auf CFTR-Mutationen zurückgeführt werden konnte.
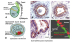
Patat et al. [12] zeigten, dass bei insgesamt 4 der Patienten ohne begleitende Nierenanomalien stattdessen verkürzende Mutationen im ADGRG2-Gen für die Störung verantwortlich sind. ADGRG2 kodiert einen G-Protein-gekoppelten Adhäsionsrezeptor, der in den Epithelzellen des proximalen Nebenhodenganges exprimiert wird [13] (Abb. 1) und sich im Tiermodell bereits als bedeutsam für die männliche Fertilität erwiesen hatte [14, 15]. Im Unterschied zum autosomalen CFTR-Gen liegt das beim Menschen etwa 130 Kilobasen und 29 Exons umfassende ADGRG2-Gen in der nicht-pseudoautosomalen Region des X- Chromosoms (Xp22.13) [16].
Mutationen werden dementsprechend durch die Mutter übertragen und prägen sich im (hemizygoten) männlichen Geschlecht aus. Patat et al. [12] konnten den X-Chromosom-gebundenen Erbgang anhand eines Familienstammbaums bestätigen und beschrieben die durch Mutationen dieses Gens hervorgerufene Störung als CBAVDX („X-linked congenital bilateral aplasia of the Vas deferens“; OMIM-Eintrag 300572). Bei den Betroffenen handelte es sich ausschließlich um Patienten ohne begleitende Nierenanomalien. Wenn also bei CBAVD-Patienten ohne Nierenanomalie keine CFTR-Mutationen gefunden werden, kann eine CBAVDX vorliegen. Die weitere Abklärung sollte eine Analyse des ADGRG2-Gens einschließen. Der Anteil der Patienten mit CBAVD und ADGRG2-Mutation ist bisher nicht bekannt, die Analyse größerer Patientenserien steht noch aus.
Methoden der Hochdurchsatzsequenzierung haben in nur wenigen Jahren die Humangenetik revolutioniert und zur Entdeckung zahlreicher neuer krankheitsverursachender Gendefekte geführt [17]. Die WES ist dabei gegenwärtig die am häufigsten angewandte Technologie. Sie beschränkt sich auf die etwa 1 % Protein-kodierenden Sequenzen des gesamten menschlichen Genoms, stellt aber trotzdem ein Schrotschuss-Verfahren dar, bei dem pro Experiment zunächst oft mehr als 20.000 Abweichungen vom Referenzgenom gefunden werden. Deshalb kommt der richtigen Strategie zur Priorisierung der gefundenen Sequenzvarianten und der anschließenden Interpretation der Daten eine zentrale Bedeutung zu.
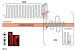
Patat et al. wandten die sogenannte Überlappungs-Strategie an [12], eine robuste und stringente Vorgehensweise, die vor allem zum Auffinden seltener dominanter Mutationen hilfreich ist [17]. In einem ersten Schritt wurde die Anzahl der möglicherweise relevanten Sequenzänderungen auf nicht-synonyme „private Varianten“ reduziert, unter denen in der Regel die verursachenden Mutationen zu finden sind. Danach wurden diejenigen Abweichungen vom Referenzgenom ausgewählt, die „Loss-of-function-“ (LoF-) Mutationen bedingen, und zwar in solchen Genen, für die eine Expression im männlichen Genitaltrakt belegt war. Dazu wurden zunächst Daten des „Humanen Protein Atlas“ zugrunde gelegt. Anhand von Literaturdaten zu Lokalisation, Expression und Funktion wurden anschließend Kandidaten-Gene ausgewählt, die in 3 unabhängigen Genomen überlappten. Dabei wurden alle häufigen Mendel‘schen Vererbungsmodi berücksichtigt [12]. ADGRG2 war das einzige überlappende Gen, dessen Expression auf die ableitenden Samenwege des männlichen Genitaltrakts konzentriert war [13]. Die Strategie identifizierte schließlich zunächst 2 hemizygote Leseraster-Mutationen, c.2845delT (p.Cys949AlafsTer81) bei einem Patienten und c.2002_2006delinsAGA (p.Leu668ArgfsTer21) bei 2 weiteren Patienten [12] (Abb. 2), die mütterlicherseits verwandt waren, ein weiteres Indiz für die X-chromosomale Vererbung.
Das Expressionsmuster des ADGRG2-Rezeptors mit seiner auffälligen Konzentration im Kopf-Abschnitt des Nebenhodens [13] sowie der charakteristische Infertilitäts-Phänotyp des Adgrg2-Gen-Knockouts [14] waren demnach wichtige Anhaltspunkte für die Priorisierung von ADGRG2 als Kandidaten-Gen und für die Identifizierung der CBAVDX-verursachenden Mutationen [12].
Einer der betroffenen azoospermen Patienten hatte sich in der Vergangenheit einer Kinderwunschbehandlung mittels epididymaler Spermienextraktion unterzogen, begleitet von einer histologischen Untersuchung des Nebenhoden-Kopfes, sodass eine Biopsie vorlag, anhand derer eine immunhistochemische Überprüfung auf Proteinebene möglich war [12]. Als Positiv-Kontrolle für den Protein-Nachweis diente das Gewebe eines Patienten mit nicht-obstruktiver Azoospermie, bei dem sich das erwartete normale ADGRG2-Expressionsmuster im Nebenhoden zeigte. Die Ergebnisse begründeten eine gezielte Sequenzierung des ADGRG2-Gens bei weiteren Patienten aus der CBAVD-Kohorte [12]. Dazu wurden alle kodierenden Exons mittels Polymerase-Ketten-Reaktion gezielt amplifiziert und anschließend sequenziert. In der Gruppe der Patienten ohne Nierenbeteiligung wurde dabei eine weitere Protein-verkürzende Mutation entdeckt: c.1545dupT (p.Glu516Ter).
Abschließend wurden die 3 neu gefundenen Mutationen mittels Sanger-Sequenzierung zusätzlich abgesichert [12]. In der Gruppe der CBAVD-Patienten mit Nierenbeteiligung fand sich dagegen keine Mutation im ADGRG2-Gen. Der pathophysiologische Mechanismus dieser Störung erscheint somit sowohl vom CFTR- als auch vom ADGRG2-Gen unabhängig und bleibt aufzuklären.
Insgesamt scheinen LoF-Mutationen des ADGRG2-Gens selten aufzutreten, übereinstimmend mit dem X-Chromosom-gebundenen (hemizygoten) Erbgang der CBAVDX. Die neu beschriebenen Mutationen waren bislang in keiner der öffentlichen Gen-Datenbanken dokumentiert. Allerdings wurden kürzlich 2 weitere CBAVD-assoziierte ADGRG2-Mutationen innerhalb der chinesischen Bevölkerung beschrieben [18]. Darüber hinaus sollen in der taiwanesischen Bevölkerung zusätzlich zu CFTR-Mutationen ebenfalls Deletionen im NHE3/Slc9a3-Gen, das einen Natrium-Protonen- (Na+/H+-) Austauscher kodiert, an der Pathogenese der CBAVD beteiligt sein [19]. Es ist deshalb anzunehmen, dass Verteilung und Häufigkeit der CBAVD-verursachenden Mutationen populationsspezifisch sind. Folglich werden die Ergebnisse abhängig von der jeweiligen ethnischen Zugehörigkeit der Patienten eine unterschiedliche Relevanz für die Praxis haben.
ADGRG2 – ein Adhäsions-G-Protein-gekoppelter Rezeptor in Ductuli efferentes und proximalem Nebenhoden
Das Produkt des ADGRG2-Gens, in der Vergangenheit auch als HE6 oder GPR64 bezeichnet [16, 20], gehört zu den Adhäsions-G-Protein-gekoppelten Rezeptoren (aGPCRs), die mit 33 Vertretern beim Menschen die zweitgrößte Rezeptor-Gruppe innerhalb der GPCR-Familie bilden [15]. Während die Funktionen und Signalübertragungswege der klassischen GPCRs inzwischen gut verstanden sind, ist über die aGPCRs bisher weit weniger bekannt. Wie die klassischen GPCRs sind auch sie große Sieben-Transmembran-spannende- (7TM-) Proteine mit extrazellulärem N-Terminus und intrazellulärem C-Terminus (Abb. 2). Auffällig ist der lange extrazelluläre Bereich, der bei vielen aGPCRs aus einer variablen Kombination funktioneller Domänen besteht [15]. Zudem haben die meisten keine löslichen Liganden, sondern binden Matrixproteine [21] oder nehmen mechanische Reize wahr [22]. Für den ADGRG2-Rezeptor ist bisher gar kein Ligand bekannt. Er gehört damit weiterhin zu den Orphan- („Waisen“-) Rezeptoren. Der N-terminale Bereich von ADGRG2 zeigt keine signifikante Übereinstimmung mit bekannten Adhäsionsdomänen; zahlreiche Splice-Varianten sprechen jedoch für einen modularen Aufbau [16]. Es bleibt zu klären, inwieweit dieser Bereich mit der Rezeptorfunktion in Zusammenhang steht.
Ein Alleinstellungsmerkmal der aGPCRs ist die sog. Gain- („GPCR autoproteolysis-inducing”-) Domäne mit der GPS („GPCR Proteolysis Site“) als zentrale Spaltstelle (Abb. 2). Hier wird die Proteinkette in 2 membrangebundene Untereinheiten gespalten, ein N-terminales Fragment (NTF) und ein C-terminales Fragment (CTF) (Abb. 2), die sowohl zusammen als auch einzeln funktionell sein können [15]. Die hohe Konservierung der GAIN/GPS-Domäne innerhalb der aGPCRs spricht dafür, dass sie ein essentieller Bestandteil der Rezeptoren ist. In der GAIN/GPS-Domäne liegt bei vielen aGPCRs außerdem die sog. Stachel-Sequenz verborgen, die nach der endoproteolytischen Spaltung freigelegt wird und nach einer bisher umstrittenen Hypothese als Molekül-interner „angebundener“ Ligand fungiert. Die Spaltung des „reifen“ ADGRG2-Proteins in 2 membranständige Untereinheiten wurde mittels Western-blot-Verfahren bereits nachgewiesen [16]; die Rolle des „Stachels“ wird derzeit untersucht [23].
ADGRG2 wurde nach seiner Entdeckung vor über 20 Jahren aufgrund seines charakteristischen Expressionsmusters im Nebenhoden zunächst als HE6-Protein (= Human Epididymis 6) beschrieben [20]. Das kodierende Gen wurde auf dem X-Chromosom lokalisiert [16]. Vergleichende Untersuchungen auf mRNA-Ebene ergaben, dass es sich um ein evolutiv hoch konserviertes Genprodukt handelt, das bei allen untersuchten Säugetieren spezifisch im Kopfabschnitt des Nebenhodens auftritt. Die zentrale 7TM-Region ist Kennzeichen der GPCRs; später wurde HE6 deshalb in GPR64 (G-Protein gekoppelter Rezeptor 64) umbenannt. Ungewöhnlich für einen GPCR erschien von Anfang an jedoch das hohe Expressionsniveau (etwa 0,1 % der mRNA im Nebenhoden [20]), das eher an ein Strukturprotein erinnerte. Auffällig war auch seine Regionen-spezifische Verteilung mit Konzentration auf den proximalen Nebenhoden. Immunfärbungen zeigen, dass das Protein in den Epithelzellen von Ductuli efferentes und proximalen Nebenhodengang konzentriert ist (Abb. 1) [13]. Hier werden 90 % der aus dem Hoden stammenden Flüssigkeit resorbiert; zahlreiche Ionenkanäle und Transporter sind an der Konzentrierung und Modifikation der luminalen Flüssigkeit beteiligt, darunter auch CFTR [24]. Laser-konfokale Studien an Perfusions-fixierten Organen der Maus belegten schließlich ein Auftreten beider ADGRG2-Untereinheiten in den apikalen Mikrovilli und Stereozilien der Prinzipalzellen, nicht jedoch in den Kinozilien der Zilien-tragenden Zellen der Ductuli efferentes (Abb. 1) [13]. Strukturelle Merkmale wie der lange N- terminale Bereich und die Spaltung innerhalb der GAIN-Domäne führten dazu, dass der Rezeptor schließlich als aGPCR klassifiziert und in ADGRG2 umbenannt wurde [15]. Datenbankeinträge belegen, dass sich die Expression von ADGRG2 nicht auf den männlichen Genitaltrakt beschränkt; geringe Mengen des Rezeptors werden auch in vielen anderen Organen gefunden [15]. Es ist aber bisher nicht bekannt, ob der ADGRG2-Rezeptor außerhalb des männlichen Genitaltrakts eine funktionelle Bedeutung hat (siehe unten). In letzter Zeit mehren sich allerdings Hinweise auf eine Überexpression von ADGRG2 in bestimmten Tumoren des Menschen [25, 26].
Die Rolle des Adgr2-Rezeptors im Tiermodell
Das auffällige und innerhalb der Säuger hoch konservierte Expressionsmuster von HE6/GPR64/ADGRG2 [13, 16, 20] führte schon früh zu der Vermutung, dass der Rezeptor für die männliche Fertilität bedeutsam sein könnte. Gleichzeitig stellen GPCRs eine wichtige Klasse von Wirkstoffzielen dar; über 30 % der verschriebenen Medikamente zielen auf diese Rezeptor-Klasse. (Neben den GPCRs sind allerdings auch Ionenkanäle wichtige Angriffspunkte von Medikamenten.) Die Identifizierung von HE6 als neuartiger GPCR des proximalen männlichen Genitaltrakts nährte deshalb die Hoffnung, mithilfe eines geeigneten Antagonisten pharmakologisch in die Funktionen des Nebenhodens eingreifen zu können. Dazu war es jedoch zunächst notwendig, seine physiologische Bedeutung aufzuklären. Da natürlich vorkommende Mutationen zu der Zeit nicht bekannt waren, lag es nahe, die Funktion durch eine gezielte Mutation im Tiermodell zu untersuchen, respektive anhand einer Adgrg2-Knockout-Maus [14]. Das „Nebenhoden-spezifische“ Expressionsmuster ließ zudem hoffen, dass die klassische Strategie eines konventionellen Gen-Knockouts zur Klärung der Funktion ausreichen und zu einem Phänotyp führen würde, der sich ausschließlich oder überwiegend im männlichen Genitaltrakt ausprägt. Wäre ein funktionsfähiger Adgrg2-Rezeptor dagegen für zentrale Organe oder sogar für den gesamten Organismus unverzichtbar, hätte dieser Ansatz ein frühzeitiges Absterben während der Embryonalentwicklung oder zumindest einen gravierenden Phänotyp in beiden Geschlechtern zur Folge.
Auf der Grundlage der hohen evolutionären Konservierung und in Kenntnis der Lokalisation auf dem X-Chromosom wurden Konstrukte für einen konventionellen Adgrg2-Knockout hergestellt [14].
Mittels homologer Rekombination wurde derjenige Genabschnitt zerstört, der das CTF inklusive der gesamten 7TM-Region von Adgrg2 kodiert (vgl. auch Abb. 2), um die vermutete Signalübertragungsfunktion auszuschalten. Die Folge war ein vollständiger Verlust beider Untereinheiten auf der Proteinebene [14]. Tatsächlich verursachte der konventionelle Knockout aber weder embryonale Letalität noch einen beide Geschlechter betreffenden gravierenden Phänotyp, ein Zeichen dafür, dass die Strategie aufgegangen war. Wie aufgrund des Expressionsmusters vermutet, beschränkte sich der Phänotyp auf den männlichen Genitaltrakt. Die hemizygoten Adgrg2-Knockout-Männchen zeigten eine deutlich verminderte Fertilität, die mit steigendem Alter immer weiter abnahm. Die große Masse der Spermien wurde in den Ductuli efferentes zurückgehalten und gelangte nicht in die weiter distal gelegenen Regionen des Nebenhodens, obwohl der Genitaltrakt in gesamter Länge vorhanden war. Die wenigen in den Samenleitern auffindbaren Spermien waren zudem missgebildet. Die weiblichen Tiere desselben Wurfs waren in ihrer Fertilität dagegen nicht vom Wildtyp zu unterscheiden [14].
Der Adgrg2-Knockout-Phänotyp in der Maus entsprach somit dem einer obstruktiven Azoospermie [14]. Anscheinend führt der Verlust des Rezeptors zu einer ungeregelten Resorption der luminalen Flüssigkeit und zu einer erhöhten Spermienkonzentration in den Ductuli efferentes; der zunehmend zähflüssige Inhalt verursacht schließlich eine Obstruktion der ableitenden Samenwege. Auf der Grundlage dieser Ergebnisse wurde HE6/GPR64/ADGRG2 zeitweise als mögliches Zielprotein für die post-testikuläre männliche Kontrazeption angesehen [27]. Allerdings zeigten die Adgrg2-Knockout-Männchen eine massive Verklumpung der Spermien in den Ductuli efferentes sowie ein stark geweitetes Rete testis mit Flüssigkeitsrückstau in die Hoden, oft verbunden mit einer Atrophie der Samenkanälchen. Diese Beobachtungen nährten schon bald den Verdacht, dass ein pharmakologischer Eingriff in die ADGRG2-Funktion irreversibel und nicht auf den post-testikulären Bereich des Genitaltrakts beschränkt sein könnte. Spezies-Unterschiede innerhalb der Eutheria, sowohl die Anatomie des Nebenhodenkopfs als auch das Expressionsmuster verschiedener Ionenkanäle entlang des männlichen Genitaltrakts betreffend, machen es allerdings schwierig, die Ergebnisse direkt auf den Menschen zu übertragen. Ähnliches gilt übrigens für die meisten Cftr-Knockout-Modelle in der Maus. Diese haben in der Regel einen anatomisch normal ausgebildeten männlichen Genitaltrakt und sind darüber hinaus auch fertil, vermutlich aufgrund der Expression eines alternativen Chlorid-Ionenkanals im männlichen Genitaltrakt, der die Funktion des Cftr-Ionenkanals übernimmt [28]. Im Unterschied dazu waren die Adgrg2-Knockout-Männchen immerhin infertil [14] und reflektieren so ein zentrales Charakteristikum der CBAVD beim Mann. Welche Relevanz das Mausmodell darüber hinaus für das Verständnis der molekularen Pathogenese der CBAVDX hat, bleibt zu klären.
„Zusammenspiel“ von ADGRG2 mit Ionenkanälen und Gerüstproteinen in Interaktions-Netzwerken – ein Ausblick
Der Einsatz von Methoden der Hochdurchsatzsequenzierung hat das lange vermutete Phänomen der genetischen Heterogenität klinisch identischer Krankheitsbilder bestätigt, jetzt auch für die CBAVD.
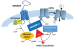
Die genetische (Lokus-) Heterogenität äußert sich dadurch, dass der Funktionsverlust genetisch nicht gekoppelter Proteine, in diesem Fall von CFTR, ADGRG2 und möglicherweise auch NHE3/SLC9A3, den gleichen klinischen Phänotyp hervorrufen kann [12, 18, 19]. Dabei sind möglicherweise nicht die Struktur und Aktivität der einzelnen Proteine ausschlaggebend, sondern die Art und Weise, wie diese funktionell miteinander verknüpft sind. CFTR, ADGRG2 und NHE3/SLC9A3 sind möglicherweise Bestandteile eines Zelltyp-spezifischen Protein-Interaktions-Netzwerks im proximalen männlichen Genitaltrakt. Tatsächlich werden alle 3 Proteine in den Mikrovilli und Stereozilien der apikalen Membrandomäne der humanen Prinzipalzellen gefunden [13, 24, 29]. Dort sind sie mit Komponenten des Zytoskeletts und mit Gerüstproteinen verbunden und stehen so in einem engen räumlichen und funktionellen Zusammenhang. Als aGPCR könnte ADGRG2 im Zentrum eines solchen Netzwerks stehen. aGPCRs beeinflussen die Organisation des apikalen Zytoskeletts, den cyclo-AMP-Spiegel und die „Rekrutierung“ von Gerüstproteinen mit sog. PDZ-Domänen [15]. (Das Akronym „PDZ“ setzt sich zusammen aus den Anfangsbuchstaben der ersten 3 Proteine, in denen diese Domäne beschrieben wurde: das Post-synaptische Density-Protein 95, das Septate junction-Protein Discs large aus Drosophila melanogaster und das Tight junction-Protein Zonula occludens-1.) Es handelt sich dabei um modular aufgebaute Interaktionsdomänen, die sequenzspezifisch an kurze Peptide innerhalb anderer Proteine binden. Wichtige PDZ-Gerüstproteine in den Epithelien des männlichen Genitaltrakts sind die Na+/H+-Exchanger Regulator Faktoren (NHERFs). CFTR ist über Mitglieder der NHERF-Familie in ein komplexes Netzwerk aus Rezeptoren, Transportern und Ionenkanälen eingebunden [24]. ADGRG2 könnte also direkt oder indirekt über die NHERF-Proteine die Aktivität des cyclo-AMP-abhängigen CFTR-Kanals sowie weiterer Ionenkanäle steuern (Abb. 3) [12, 30].
Entlang der Ductuli efferentes und des Nebenhodens entsteht durch aktive inter- und transzelluläre Transportprozesse ein zeitlich und regional sich stetig wandelndes luminales Milieu, das für die funktionelle Reifung, den Transport und die Speicherung der Spermien notwendig ist. Die beteiligten Epithelien mit ihren spezifischen apikalen Differenzierungen und Zellverbindungen entwickeln sich während der Ontogenese. Infolge dessen sind zu unterschiedlichen Zeiten in den verschiedenen Zelltypen und Regionen des männlichen Genitaltrakts eine Vielzahl von Protein-Interaktions-Netzwerken an der Integration dieser Prozesse beteiligt [24]. Die Ergebnisse basieren noch weitgehend auf Untersuchungen in Tiermodellen und/oder Zellkulturen. Die neuen Erkenntnisse aus der humangenetischen Forschung tragen jetzt dazu bei, die Komponenten dieser Netzwerke auch beim Menschen zu identifizieren. Vor dem Hintergrund der rasanten Entwicklung der Sequenzierungsmethoden der „nächsten Generation“ ist die Entdeckung von ADGRG2 als ein wichtiger „Mitspieler“ womöglich erst der Anfang eines Prozesses, der ausgehend von den einzelnen Bausteinen langfristig zu einem vollständigen Verständnis der molekularen Prozesse im männlichen Genitaltrakt führen könnte. Neben der grundlagenwissenschaftlichen Bedeutung haben die neuen Befunde aber möglicherweise auch Konsequenzen für die Familienplanung von Kinderwunschpaaren und sollten bei der Beratung von CBAVD-Patienten bedacht werden.
Es bleibt zu wünschen, dass für Patienten mit isolierter CBAVD ohne Nierenbeteiligung in Zukunft auch Tests zur Identifizierung von ADGRG2-Mutationen zur Verfügung stehen. Immerhin stellt die richtige Diagnose für betroffene Familien eine wichtige Entscheidungshilfe dar.
Interessenkonflikt
Die Autorin gibt an, dass kein Interessenkonflikt besteht.
Literatur:
1. Behre HM, Nieschlag E, Weidner W, Wieacker P. Diseases of the seminal ducts. In: Nieschlag E, Behre HM, Nieschlag S (eds). Andrology – Male Reproductive Health and Dysfunction. 3. Aufl., Springer-Verlag, Heidelberg, Dordrecht, London, New York, 2010; 263–78.
2. Lissens W, Mercier B, Tournaye H, Bonduelle M, Férec C, et al. Cystic fibrosis and infertility caused by congenital bilateral absence of the vas deferens and related clinical entities. Hum Reprod 1996; (Suppl 4): 55–78.
3. Yu J, Chen Z, Ni Y, Li Z. CFTR mutations in men with congenital bilateral absence of the vas deferens (CBAVD): a systemic review and meta-analysis. Hum Reprod 2012; 27: 25–35.
4. de Souza DAS, Faucz FR, Pereira-Ferrari L, Sotomaior VS, Raskin S. Congenital bilateral absence of the vas deferens as an atypical form of cystic fibrosis: reproductive implications and genetic counseling. Andrology 2018; 6: 127–35.
5. Chillón M Casals T, Mercier B, Bassas L, Lissens W, Silber S, et al. Mutations in the cystic fibrosis gene in patients with congenital absence of the vas deferens. N Engl J Med 1995; 332: 1475–80.
6. Cutting GR. Cystic fibrosis genetics: from molecular understanding to clinical application. Nat Rev Genet 2015; 16: 45–56.
7. Stuhrmann M, Dörk T. CFTR gene mutations and male infertility. Andrologia 2000; 32: 71–83.
8. Kleinle S, Koehler U, González Fassrainer D, Holinski-Feder E. Genetische Untersuchungen in der Reproduktionsmedizin. J Reproduktionsmed Endokrinol 2015; 12: 57–64.
9. Dohle GR, Veeze HJ, Overbeek SE, van den Ouweland AM, Halley DJ, et al. The complex relationships between cystic fibrosis and congenital bilateral absence of the vas deferens: clinical, electrophysiological and genetic data. Hum Reprod 1999; 14: 371–4.
10. Jarvi K, McCallum S, Zielenski J, Durie P, Tullis E, et al. Heterogeneity of reproductive tract abnormalities in men with absence of the vas deferens: role of cystic fibrosis transmembrane conductance regulator gene mutations. Fertil Steril 1998; 70: 724–8.
11. McCallum T, Milunsky J, Munarriz R, Carson R, Sadeghi-Nejad H, Oates R. Unilateral renal agenesis associated with congenital bilateral absence of the vas deferens: phenotypic findings and genetic considerations. Hum Reprod 2001; 16: 282–8.
12. Patat O, Pagin A, Siegfried A, Mitchell V, Chassaing N, et al. Truncating Mutations in the Adhesion G Protein-Coupled Receptor G2 Gene ADGRG2 Cause an X-Linked Congenital Bilateral Absence of Vas Deferens. Am J Hum Genet 2016; 99: 437–42.
13. Kirchhoff C, Osterhoff C, Samalecos A. HE6/GPR64 adhesion receptor co-localizes with apical and subapical F-actin scaffold in male excurrent duct epithelia. Reproduction 2008;136: 235–45.
14. Davies B, Baumann C, Kirchhoff C, Ivell I, Nubbemeyer R, et al. Targeted Deletion of the Epididymal Receptor HE6 Results in Fluid Dysregulation and Male Infertility. Mol Cell Biol 2004; 24: 8642–8.
15. Hamann J, Aust G, Araç D, Engel FB, Formstone C, et al. International Union of Basic and Clinical Pharmacology. XCIV. Adhesion G protein-coupled receptors. Pharmacol Rev 2015; 67: 338–67.
16. Obermann H, Samalecos A, Osterhoff C, Schröder B, Heller R, Kirchhoff C. HE6, a two-subunit heptahelical receptor associated with apical membranes of efferent and epididymal duct epithelia. Mol Reprod Dev 2003; 64: 13–26.
17. Neveling K, Hoischen A. Exom-Sequenzierung zur Identifizierung von Krankheitsgenen. Med Gen 2012; 24: 4–11.
18. Yang B, Wang J, Zhang W, Pan H, Li T, et al. Pathogenic role of ADGRG2 in CBAVD patients replicated in Chinese population. Andrology 2017; 5: 954–7.
19. Wang YY, Lin YH, Wu YN, Chen YL, Lin YC, et al. Loss of SLC9A3 decreases CFTR protein and causes obstructed azoospermia in mice. PLoS Genet 2017; 13: e1006715.
20. Osterhoff C, Ivell R, Kirchhoff C. Cloning of a human epididymis-specific mRNA, HE6, encoding a novel member of the seven transmembrane-domain receptor superfamily. DNA Cell Biol 1997; 16: 379–89.
21. Mehta P, Piao X. Adhesion G-protein coupled receptors and extracellular matrix proteins: Roles in myelination and glial cell development. Dev Dyn 2017; 246: 275–84.
22. Scholz N, Guan C, Nieberler M, Grotemeyer A, Maiellaro I, et al. Mechano-dependent signaling by Latrophilin/CIRL quenches cAMP in proprioceptive neurons. eLife 2017; 6:e28360.
23. Demberg LM, Winkler J, Wilde C, Simon KU, Schön J, et al. Activation of Adhesion G Protein-coupled Receptors: Agonist specificity of satchel sequence-derived peptides. J Biol Chem 2017; 292: 4383–94.
24. Breton S, Ruan YC, Park YJ, Kim B. Regulation of epithelial function, differentiation, and remodeling in the epididymis. Asian J Androl 2016; 18: 3–9.
25. Richter GH, Fasan A, Hauer K, Grunewald TG, Berns C, et al. G-Protein coupled receptor 64 promotes invasiveness and metastasis in Ewing sarcomas through PGF and MMP1. J Pathol 2013; 230: 70–81.
26. Balenga N, Azimzadeh P, Hogue JA, Staats PN, Shi Y, et al. Adhesion GPCR GPR64/ADGRG2 Is Overexpressed in Parathyroid Tumors and Attenuates Calcium-Sensing Receptor-Mediated Signaling. J Bone Miner Res 2017; 32: 654–66.
27. Gottwald U, Davies B, Fritsch M, Habenicht UF. New approaches for male fertility control: HE6 as an example of a putative target. Mol Cell Endocrinol 2006; 250: 49–57.
28. Guilbault C, Saeed Z, Downey GP, Radzioch D. Cystic Fibrosis Mouse Models. Am J Respir Cell Mol Biol 2007; 36: 1–7.
29. Kujala M, Hihnala S, Tienari J, Kaunisto K, Hästbacka J, et al. Expression of ion transport-associated proteins in human efferent and epididymal ducts. Reproduction 2007; 133: 775–84.
30. Zhang DL, Sun YJ, Ma ML, Wang YJ, Lin H, et al. Gq activity- and ?-arrestin-1 scaffolding-mediated ADGRG2/CFTR coupling are required for male fertility. Elife 2018; eLife.33432.