Dia-Präsentation von Solvay Pharma aus dem Jahr 2003 Omega-3-Fettsäuren (77 Abbildungen) Übersicht Gesamtpräsentation zum Download (rechte Maustaste und "Ziel speichern unter..." klicken)
| ||||||||||||||||||
Abbildung 69: Mögliche Interaktionen der Omega-3-Fettsäuren mit Natriumkanälen Untersuchungen an Kardiomyozyten zeigen, dass Omega-3-Fettsäuren direkt mit Natriumkanälen interagieren. So wird Batrachotoxin, ein Neurotoxin, das selektiv an Natriumkanäle vom L-Typ bindet, durch EPA dosisabhängig aus dieser Bindung verdrängt. Omega-3-Fettsäuren binden entweder innerhalb der Phospholipid-Doppelmembran an Na+-Kanalproteine oder lagern sich in hydrophoben Bereichen der Proteine selbst an. Hierdurch ändert sie wahrscheinlich deren räumliche Struktur so, dass die elektrische Reizbarkeit der Natriumkanäle abnimmt. Xiao et al. konnten an humanen Na+-Kanalproteinen zeigen, das bereits der Austausch einer einzelnen Aminosäure (N406K) im Protein zu einer achtfach geringeren inhibitorischen Wirkung von EPA führt. Dies belegt die hohe Spezifität der Interaktionen von Omega-3-Fettsäuren und Tunnelproteinen. Kang J X, Leaf A: Evidence that free polyunsaturated fatty acids modify Na+ channels by directly binding to the channel proteins. PNAS 1996; 93: 3542 – 3546 Xiao Y F, Ke Q, Wang S Y et al.: Single point mutations affect fatty acid block of human myocardial sodium channel alpha subunit Na+ channels. PNAS 2001; 98: 3606 - 3611 |
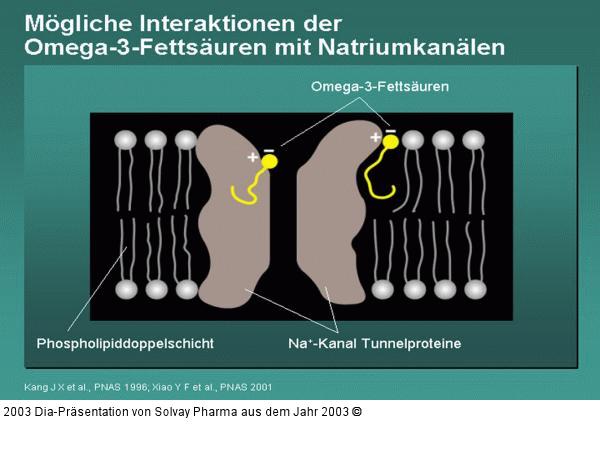
Abbildung 69: Mögliche Interaktionen der Omega-3-Fettsäuren mit Natriumkanälen
Untersuchungen an Kardiomyozyten zeigen, dass Omega-3-Fettsäuren direkt mit Natriumkanälen interagieren. So wird Batrachotoxin, ein Neurotoxin, das selektiv an Natriumkanäle vom L-Typ bindet, durch EPA dosisabhängig aus dieser Bindung verdrängt. Omega-3-Fettsäuren binden entweder innerhalb der Phospholipid-Doppelmembran an Na+-Kanalproteine oder lagern sich in hydrophoben Bereichen der Proteine selbst an. Hierdurch ändert sie wahrscheinlich deren räumliche Struktur so, dass die elektrische Reizbarkeit der Natriumkanäle abnimmt. Xiao et al. konnten an humanen Na+-Kanalproteinen zeigen, das bereits der Austausch einer einzelnen Aminosäure (N406K) im Protein zu einer achtfach geringeren inhibitorischen Wirkung von EPA führt. Dies belegt die hohe Spezifität der Interaktionen von Omega-3-Fettsäuren und Tunnelproteinen. Kang J X, Leaf A: Evidence that free polyunsaturated fatty acids modify Na+ channels by directly binding to the channel proteins. PNAS 1996; 93: 3542 – 3546 Xiao Y F, Ke Q, Wang S Y et al.: Single point mutations affect fatty acid block of human myocardial sodium channel alpha subunit Na+ channels. PNAS 2001; 98: 3606 - 3611 |